全球范围内,前列腺癌发病率位于男性肿瘤第二位, 死亡率位于第五,每年新发前列腺癌超110万例, 并会有 30多万人死于前列腺癌。在中国,根据2015年国家癌症协会的报告估计,前列腺癌发病率排第六位,死亡率位于第十。前列腺癌已成为严重威胁全球中老年男性健康的疾病,并且发病呈年轻化趋势。在临床治疗上,虽然早期前列腺癌可以通过手术切除,放疗等根治治疗,但侵袭性前列腺癌(aggressive prostate cancer)患者的预后往往较差,并通常伴随着转移。因此,对于前列腺癌,尤其是侵袭性前列腺癌的发病机制研究和治疗方法的探究十分重要。

据报道,亚洲男性前列腺癌的发病率远低于非洲裔美国人和欧洲白种人,表明遗传背景是该病因和发展的一个重要风险因素。随着全基因组关联研究(GWAS)的推广,近十几年来,我们对前列腺癌遗传易感性的理解有了很大的发展,迄今为止已经发现了超过150个与前列腺癌风险相关的单核苷酸多态性(SNP)位点,其中部分位点的生物学效应和致病机制也有了深入的阐述。相比之下,我们对于侵袭性前列腺癌的遗传风险因素了解甚少,目前GWAS仅确定几个侵袭性前列腺癌易感位点,包括19q13位点的rs11672691。最近的GWAS荟萃分析报道,位于长链非编码RNA(lncRNA)PCAT19(前列腺癌相关转录物19)第二内含子内的rs11672691不仅与前列腺癌易感性有关,而且与其侵袭性显著相关。有趣的是,在另一项大型队列(10487例患者,随访时间平均8.3年)研究中,观察到rs11672691与前列腺癌死亡风险增加相关联。2018年7月26日,Cell杂志发表了我司2000届员工,芬兰奥卢大学卫功宏教授团队的研究论文,深入阐释侵袭性前列腺癌风险位点19q13的分子遗传和生物学机制,以及该发现的潜在临床应用。
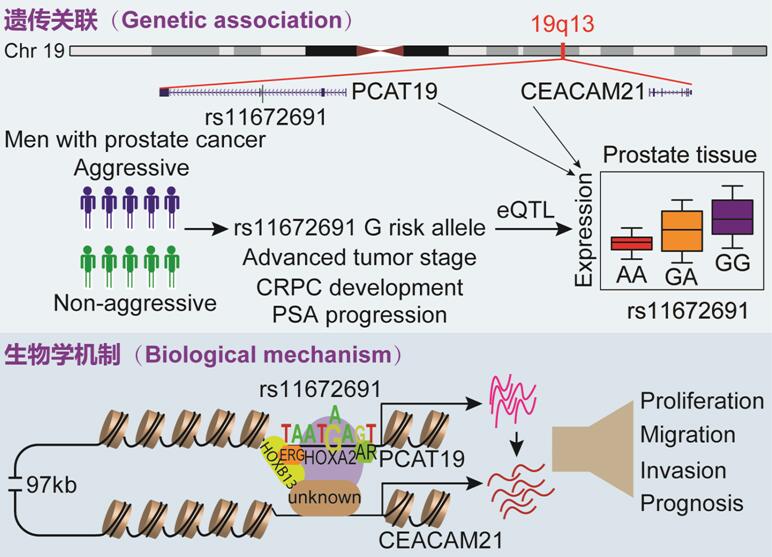
在该项研究中,科研人员首先整合了2738例前列腺癌病人,并且根据临床特征分成侵袭性和非侵袭性病人组,发现携带rs11672691[G]风险等位基因的患者治疗后前列腺特异性抗原进展(PSA
progression), 发展为晚期肿瘤和去势抵抗性前列腺癌(CRPC)的风险显著性增加。接下来该团队试图找出致病基因(causal genes),rs11672691是否与附近基因的表达相关,通过使用来自三个独立群组,包括近1000例前列腺组织样品的数据进行表达数量性状基因座(eQTL)分析,发现风险rs11672691[G]与两个新基因PCAT19和CEACAM21的高转录本水平呈显著性正相关,并进一步证实它们可调控前列腺癌细胞生长和迁移,以及在肿瘤进展中表达量增加。在生物学机制方面,该工作揭示rs11672691存在于增强子区(enhancer),位于新发现的癌相关转录因子HOXA2的DNA结合基序(motif),风险rs11672691[G]促进HOXA2和该增强子区的结合,并形成染色质环(Chromatin Loop),进而可能上调PCAT19和CEACAM21的转录表达。该研究同时发现lncRNA PCAT19也上调CEACAM21的表达(下图)。CRISPR/Cas9基因编辑技术介导的单核苷酸编辑显示rs11672691对PCAT19和CEACAM21的表达以及前列腺癌细胞侵袭性表型有直接作用。
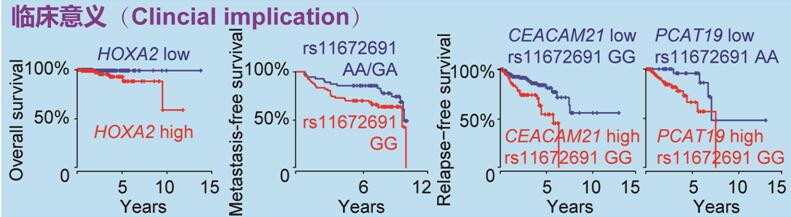
在临床方面,研究人员发现HOXA2和CEACAM21可独立作为潜在的预后分子标志物,HOXA2表达水平可用于区分可能在中度风险前列腺癌组(Gleason评分7)中复发的患者,CEACAM21较高表达水平的患者组具有增加生化复发的风险等。更有意思的是,根据rs11672691的基因型可以直接预测前列腺癌病人的预后情况,rs11672691基因型和PCAT19或CEACAM21基因表达对前列腺癌预后有着显著协同作用(下图)。综合这些结果为rs11672691与侵袭性前列腺癌相关提供了合理的机制解释,因此奠定了可能将这一发现转化为临床的基础。
卫功宏教授简介: 卫功宏于1996-2000年间本科就读于皇冠新款入口,现为芬兰奥卢大员工化与分子医学学院教授,生物中心资深研究组长,同时获芬兰科学院研究员项目资助。该研究组主要运用生物化学、分子细胞生物学、表观遗传和功能基因组学、新一代高通量技术和生物信息学方法等研究肿瘤易感、发生、发展和转移的分子生物学机制,以及潜在的临床转化应用。近年来以通讯或资深作者在Cell, Nature Genetics, Nature Communications, (Clinical)Cancer Research等期刊上发表系列研究论文。研究工作曾受到国际一流杂志Cell, Nature Genetics, Cancer Discovery, Nature Reviews Urology等和Faculty of 1000的关注和点评,以及 Science Daily,赫尔辛基日报等媒体的报道。
参考文献 (略)

